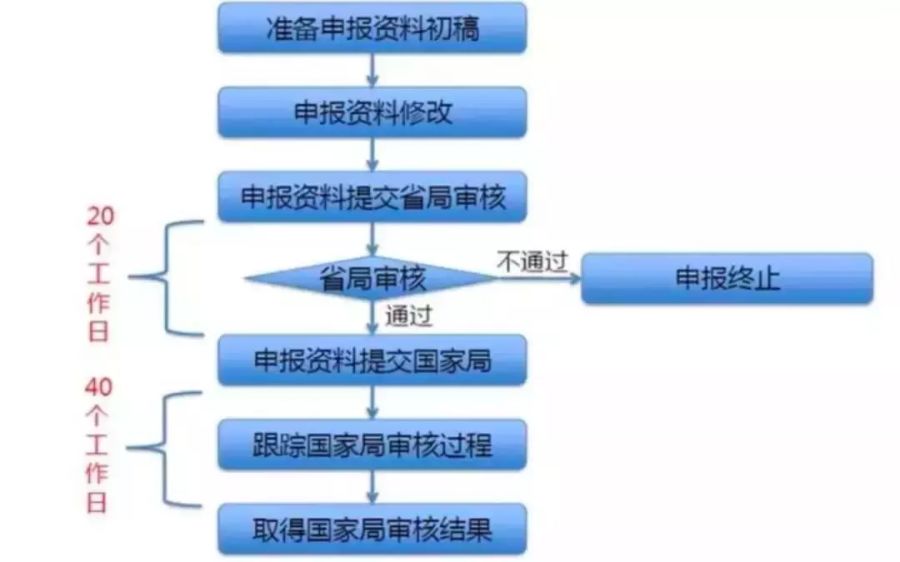
對于醫(yī)療器械生產(chǎn)初創(chuàng)企業(yè)而言�����,產(chǎn)品從研發(fā)設計階段到走向消費市場���,至少應經(jīng)歷設計開發(fā)、注冊檢測��、臨床試驗�����、注冊申報、生產(chǎn)許可申請等漫長的無盈利過程�。那么,如何評估產(chǎn)品安全性風險����、申報注冊周期、投入資金與成本����?都是初創(chuàng)企業(yè)創(chuàng)始人最關心的問題?��;谏鲜鰡栴}�����,小編進行按照醫(yī)療器械產(chǎn)品設計開發(fā)����、體系建立�����、創(chuàng)新產(chǎn)品申報(若涉及)��、注冊檢測、臨床試驗����、注冊申報、生產(chǎn)許可申請��、產(chǎn)品上市等必要階段進行簡單整理��。
產(chǎn)品設計開發(fā)流程
產(chǎn)品設計開發(fā)可分7個階段:策劃階段�����、設計輸入階段�����、設計輸出階段��、小試階段�����、中試階段�、定型階段�、注冊資料準備階段���。
產(chǎn)品設計開發(fā)要點
一般而言,創(chuàng)始人創(chuàng)立公司是基于科研成果與產(chǎn)品布局基礎上���,并已初步具備研發(fā)團隊���、合作伙伴等。但無論如何�����,對于初創(chuàng)公司而言�����,因涉及大量資金注入與技術攻堅����,產(chǎn)品設計開發(fā)階段十分艱難,時間也是難以預估的�����,短則數(shù)月�����,長則數(shù)年。那么���,如何在產(chǎn)品設計開發(fā)階段降低成本���,滿足需求,增加創(chuàng)新����?
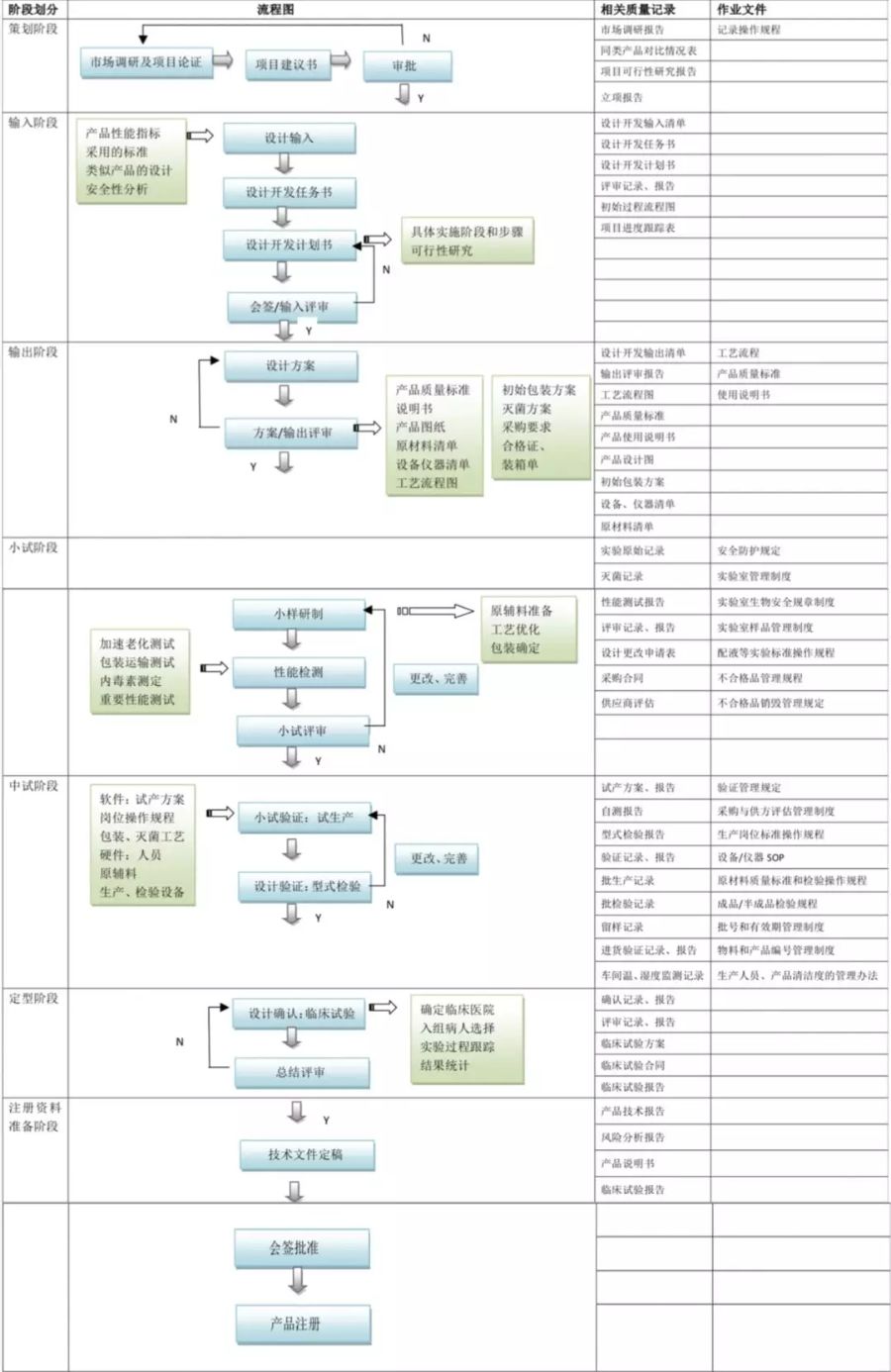
首先,產(chǎn)品技術層面����,專業(yè)高效的研發(fā)團隊是前提和基礎;其次��,法規(guī)層面建議尋找專業(yè)研發(fā)服務公司或引進法規(guī)團隊對產(chǎn)品開發(fā)進行嚴格的風險評估����,明確產(chǎn)品申報類型等��。但我們常常發(fā)現(xiàn)�,很多新辦企業(yè)在產(chǎn)品已定型����、開模后�,才開始引進法規(guī)人員或?qū)ふ易稍儥C構。此時的建議和措施往往基于補救����,嚴重的可能涉及改模、重新設計等����。所以對于新辦企業(yè)而言,法規(guī)前置應慎重考量����。最后,還應關注產(chǎn)品專利布局�。公司應重點布局核心技術的知識產(chǎn)權保護;同時���,考慮核心技術轉(zhuǎn)讓�、購買等問題��。產(chǎn)品的專利申報可以委托相應機構,后期若涉及專利較多��,亦可引入專職人員�。
創(chuàng)新醫(yī)療器械申報
2014年2月7日,原國家食藥監(jiān)總局發(fā)布了《創(chuàng)新醫(yī)療器械特別審批程序(試行)》(食藥監(jiān)械管〔2014〕13號)���,此文件自2014年3月1日起施行�����。該程序是在確保上市產(chǎn)品安全��、有效的前提下�����,針對創(chuàng)新醫(yī)療器械設置的審批通道�,但也有嚴苛的審批標準:
(1)產(chǎn)品核心技術發(fā)明專利權,審批申請人經(jīng)過其技術創(chuàng)新活動���,在中國依法擁有產(chǎn)品核心技術發(fā)明專利權�,或者依法通過受讓取得在中國發(fā)明專利權或其使用權,或者核心技術發(fā)明專利的申請已由國務院專利行政部門公開;
(2)國內(nèi)首創(chuàng)產(chǎn)品,主要工作原理/作用機理為國內(nèi)首創(chuàng)����,產(chǎn)品性能或者安全性與同類產(chǎn)品比較有根本性改進��,技術上處于國際領先水平,并且具有顯著的臨床應用價值;
(3)產(chǎn)品基本定型,申請人已完成產(chǎn)品的前期研究并具有基本定型產(chǎn)品���,研究過程真實和受控����,研究數(shù)據(jù)完整和可溯源����。
若企業(yè)醫(yī)療產(chǎn)品設計滿足上述要求,則應著手申報創(chuàng)新�����。創(chuàng)新特別審批是申請人已完成產(chǎn)品的前期動物研究并具有基本定型產(chǎn)品即可申報�。